Tofacitinibcitraat is een receptgeneesmiddel (handelsnaam Xeljanz) dat oorspronkelijk door Pfizer werd ontwikkeld voor een klasse orale Januskinase-remmers (JAK-remmers). Het kan JAK-kinase selectief remmen, JAK/STAT-routes blokkeren en daardoor celsignaaltransductie en gerelateerde genexpressie en activering remmen, die worden gebruikt voor de behandeling van reumatoïde artritis, artritis psoriatica, colitis ulcerosa en andere immuunziekten.
Het medicijn omvat drie doseringsvormen: tabletten, tabletten met verlengde afgifte en orale oplossingen. De tabletten werden voor het eerst goedgekeurd door de FDA in 2012, en de doseringsvorm met verlengde afgifte werd in februari 2016 door de FDA goedgekeurd. Het is de eerste die reumatoïde gewrichten behandelt. Yan is een JAK-remmer die eenmaal daags oraal wordt ingenomen. In december 2019 werd opnieuw een nieuwe indicatie voor geneesmiddelen met verlengde afgifte goedgekeurd voor matige tot ernstige actieve colitis ulcerosa (UC). Bovendien zijn de huidige fase 3 klinische onderzoeken voor plaque psoriasis voltooid en zijn er nog zes fase 3 klinische onderzoeken aan de gang, waarbij actieve artritis psoriatica, juveniele idiopathische artritis, enz. betrokken zijn. Soort indicaties. De voordelen van tabletten met verlengde afgifte, die langwerkend zijn en slechts één keer per dag hoeven te worden ingenomen, zijn bevorderlijk voor de behandeling en controle van de ziekten van patiënten.
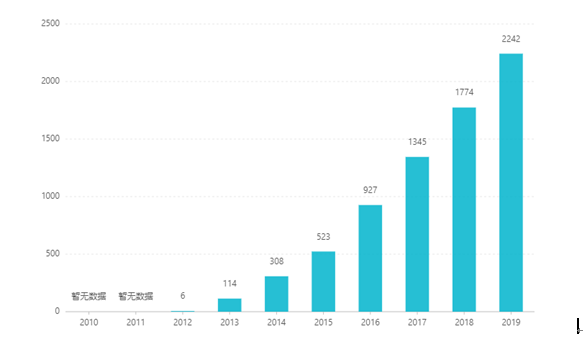
Sinds de beursgang is de omzet jaar na jaar gestegen tot 2,242 miljard dollar in 2019. In China werd de tabletdoseringsvorm in maart 2017 goedgekeurd voor marketing en werd in 2019 via onderhandelingen opgenomen in de categorie B-catalogus van de ziektekostenverzekering. bod bedraagt RMB 26,79. Vanwege de hoge technische barrières van preparaten met verlengde afgifte is deze doseringsvorm echter nog niet in China op de markt gebracht.
JAK-kinase speelt een belangrijke rol bij ontstekingen en er is aangetoond dat de remmers ervan bepaalde ontstekings- en auto-immuunziekten behandelen. Tot nu toe zijn wereldwijd zeven JAK-remmers goedgekeurd, waaronder Delgocitinib van Leo Pharma, Fedratinib van Celgene, upatinib van AbbVie, Pefitinib van Astellas, Baritinib van Eli Lilly en Rocotinib van Novartis. Van de bovengenoemde geneesmiddelen zijn echter alleen tofacitinib, baritinib en rocotinib in China goedgekeurd. We kijken ernaar uit dat Qilu's “Tofatib Citrate Sustained Release Tablets” zo snel mogelijk worden goedgekeurd en meer patiënten hiervan zullen profiteren.
In China werd het oorspronkelijke onderzoek naar tofacitibcitraat in maart 2017 door de NMPA goedgekeurd voor de behandeling van volwassen RA-patiënten met onvoldoende werkzaamheid of intolerantie voor methotrexaat, onder de handelsnaam Shangjie. Volgens gegevens van Meinenet bedroeg de verkoop van tofacitibcitraattabletten in de Chinese openbare medische instellingen in 2018 8,34 miljoen yuan, wat veel lager was dan de wereldwijde verkoop. Een groot deel van de reden is de prijs. Naar verluidt bedroeg de initiële verkoopprijs van Shangjie 2085 yuan (5 mg*28 tabletten) en de maandelijkse kosten 4170 yuan, wat geen kleine last is voor gewone gezinnen.
Het is echter de moeite waard om te vieren dat tofacitib na onderhandelingen in november 2019 door de National Medical Insurance Administration is opgenomen in de 2019 “National Basic Medical Insurance, Work Injury Insurance and Maternity Insurance Drug List”. Er wordt gemeld dat het maandelijkse bedrag zal worden verlaagd. tot onder de 2.000 yuan nadat over de prijsverlaging is onderhandeld, wat de beschikbaarheid van het medicijn aanzienlijk zal verbeteren.
In augustus 2018 nam de Patent Reexamination Board van het State Intellectual Property Office een herzieningsbesluit nr. 36902, verzoek tot nietigverklaring, en verklaarde het kernoctrooi van Pfizertofatib, het samengestelde patent, ongeldig op grond van onvoldoende openbaarmaking van de specificatie. Het patent op de kristalvorm van Pfizertofatiib (ZL02823587.8, CN1325498C, aanvraagdatum 25-11-2002) loopt in 2022 af.
Uit de Insight-database blijkt dat, naast het oorspronkelijke onderzoek, vijf generieke geneesmiddelen van Chia Tai Tianqing, Qilu, Kelun, Yangtze River en Nanjing Chia Tai Tianqing zijn goedgekeurd voor marketing in de binnenlandse tofacitinib-tabletformuleringen. Voor het tablettype met verlengde afgifte heeft Pfizer op 26 mei echter alleen het oorspronkelijke onderzoek ingediend. Qilu is het eerste binnenlandse bedrijf dat een marketingaanvraag voor deze formulering heeft ingediend. Bovendien bevindt CSPC Ouyi zich in de BE-proeffase.
Changzhou Pharmaceutical Factory (CPF) is een toonaangevende farmaceutische fabrikant van API's en afgewerkte formuleringen in China, gevestigd in Changzhou, provincie Jiangsu. CPF is opgericht in 1949. We hebben ons vanaf 2013 gewijd aan Tofacitinib Citraat en hebben DMF al ingediend. We zijn in veel landen geregistreerd en kunnen u ondersteunen met de beste documentenondersteuning voor Tofacitinib Citraat.
Posttijd: 23 juli 2021